要旨
超音波内視鏡EUSによる粘膜下腫瘍の診断は,主存在層(由来層),腫瘍のエコーレベル,内部エコーパターンにより鑑別診断がある程度可能である.脂肪腫,リンパ管腫,嚢胞は,特徴的な所見を有するため,Endoscopic ultrasound-guided fine-needle aspiration(EUS-FNA)の必要性はない.迷入膵とGlomus腫瘍は,3,4層由来の腫瘍として同定され,前庭部に多く認められる.しかしながら,4層が肥厚様に描出される3,4層由来の迷入膵(深層型)は,多くは大きく,胃体部に見られることが多い.各々の粘膜下腫瘍は,特徴的な所見を有するが,第4層由来の腫瘍の画像診断による鑑別診断は,たとえ造影エコーを用いても難しい.それゆえ,これらの鑑別にはEUS-FNAを行わなければならない.しかしながら,小さな腫瘍に対するEUS-FNAの診断能は,臨床的な要求を満足するものではないため,第4層由来のこれらの腫瘍は,最初は6カ月後に経過観察し,もしもその時点で大きさ,形態が大きく変化してない場合には1年毎の経過観察とすべきと考えている.これらの腫瘍が1-2cm以上となった時点で,EUS-FNAによる診断が推奨される.さらに,結節分葉状,内部不均一,無エコー域,潰瘍などの悪性所見を有するなど通常とは異なる粘膜腫瘍もEUS-FNAの適応である.フードを装着した直視型超音波内視鏡は,小さな粘膜下腫瘍に対するEUS-FNAに有用である.
Ⅰ はじめに
超音波内視鏡(endoscopic ultrasonography;EUS)は,粘膜表面を観察する通常内視鏡と異なり,断層像が観察出来る特殊な検査法である.そして1984年相部らにより,消化管が5層構造と組織との対応が明らかになるとEUSは,粘膜下腫瘍の診断,消化管悪性腫瘍の深達度診断などに用いられるようになり,最近では消化管疾患の診断においても確固たる地位を築いている(Figure 1)
1).さらに,1992年に,Vilmannらが
2),超音波内視鏡下穿刺吸引細胞診・生検(EUS guided fine needle aspiration cytology & biopsy;EUS -FNA),を報告以来,膵仮性囊胞ドレナージ,EUS下腹腔神経叢ブロック,EUS下胆道ドレナージ(EUS-CDS,EUS-HGS),EUS下膵管ドレナージ,膵腫瘍に対する局注療法,焼灼療法(エタノール局注,ablation)などとその応用範囲を拡げている現状にある.本稿では,粘膜下腫瘍に対するEUS/EUS-FNAの診断・治療につき解説する.
Ⅱ 超音波内視鏡による粘膜下腫瘍の画像診断
1)主存在層(由来層)による粘膜下腫瘍の診断
消化管壁は,比較的低い周波数(7.5-12MHz)の超音波内視鏡で観察すると5層構造として,比較的高周波数(12-20MHz)で観察すると9層構造として描出される(Figure 1).消化管粘膜下腫瘍に対するEUSによる鑑別は,腫瘍が発生した主存在層と内部エコーレベル,内部エコーパターンによりある程度可能となる(Figure 2,3).
主存在層から見ると脂肪腫,線維腫,リンパ管腫,ブルンナー腺腫などは第3層由来である.迷入膵は,基本的には第3層由来であるが,前庭部に見られる小さなものは第3層由来のものが多く(浅層型),胃体部に見られるものは3,4層にまたがって存在し一見4層が肥厚しているように見え(4層の肥厚所見,深層型),大きなものが多いとされる.GIST,平滑筋腫,神経鞘腫等は第4層由来である.Glomus腫瘍は,基本的には第4層を主体とするものが多いが,3,4層にまたがっている症例もありこれが特徴の一つとされる(Figure 4).食道に多く見られる顆粒細胞腫は,第2層由来であるが,稀に見られる胃,大腸の顆粒細胞腫は2-3層由来であり,悪性化例もある.転移性腫瘍は,一般的に第3層由来で,多発性であること,中心陥凹,潰瘍を伴うのが特徴的である.一般的に主存在層の評価には,コンベックス式EUSよりラジアル式EUSが腫瘍と正常胃壁との連続性が描出でき優れている.
2)エコーレベルによる診断
体内には,標準的なエコーレベルがないため,消化管の粘膜下層のエコーレベルを高エコー,脂肪肝のない正常肝臓,脾臓のエコーレベルを等エコー,消化管の第4層を低エコー,水のエコーレベルを無エコーとして評価するのが一般的である.
エコーレベルから見ると,脂肪腫が高エコーとして,リンパ管腫,嚢胞などは無エコーを呈して同定される.神経内分泌腫瘍(NET),ガストリノーマ,リンパ腫などが低エコーを呈しており,ブルンナー腺腫,迷入膵などは等~やや低エコーを呈し,GIST,平滑筋腫,神経鞘腫は,やや低エコー~低エコーを呈している(Figure 3).
3)内部エコーパターンによる診断
内部エコーパターンからみると大部分は内部が充実性に同定されるが,嚢胞,リンパ管腫などではcysticに描出される.その鑑別は,嚢胞は,分葉はするが内部には隔壁構造を有さないことが多い.一方リンパ管腫は,嚢胞内が薄い隔壁により細分化されていることが特徴的である.しかし,両者ともSolid成分を有さない点では共通している.その一方で,迷入膵,過誤腫,ブルンナー腺腫などは,時に嚢胞を有する病変として描出されるが,これらの病変は,その一部分に小さいかもしれないがSolidな部分を必ず有する腫瘍として描出され,これが鑑別点となる.Schirhous胃癌,アミロイドーシス等の疾患では,粘膜下腫瘍と異なり境界不明瞭な壁肥厚所見が大切であり,その点に気づけば診断可能となる.Schirhous胃癌は全層性肥厚であり,アミロイドーシスは第3層主体の肥厚である.しかしこれらのEUS診断によっても100%鑑別できるわけではなく,非典型例では組織学的診断が必要となり,EUS-FNAを行わなければならない.
Ⅲ 疾患別各論
1)GIST
GISTは,最も多く見られる非上皮性腫瘍で,第4層から発生するやや低エコー~低エコーの腫瘤でMalignant potentialを有する(Figure 4).発生的にGISTは,間質細胞であるCajal細胞由来の腫瘍とされ,C-kit(CD117)とCD-34などの免疫組織学的陽性が特徴的として診断される.そして胃内の4層由来の腫瘍の70~90%を占めるとされる
3),4).更に,GISTの分布は,胃体部に発生するものが46.4~58%と多く,次に胃底部21~33.3%,前庭部に13~18.9%,噴門部に1.4~8%と報告されている
3),4).NCCNガイドラインによれば,GISTはどんなに小さくても手術適応とされている.しかし,その診断は容易ではない.われわれは,1992年に胃の4層由来の粘膜下腫瘍に対する悪性所見を報告した.すなわち,①3cm以上,②結節分葉状,③内部不均一,④無エコー域,⑤潰瘍の所見のうち3つ以上有するものは悪性とするものである
5).また,GISTは石灰化を有することが,他の4層由来の腫瘍平滑筋腫,神経鞘腫と比較して少ない(0~3.5%)
3),5).High risk malignancy GISTは,コントラストエコーで,hypervascular patternを呈し,平滑筋腫や神経鞘腫との鑑別に容易であるとの報告もあるが
6),low risk等の他のGISTが臨床上は多く存在し,画像による鑑別診断は現時点では困難で,EUS-FNAによる組織学的診断が必要と考えている.一般的には,1cmまでの粘膜下腫瘍に対するEUS-FNAの成績は40~50%,11~30mmまでが60~70%とされており,小さなものに対する成績は臨床的要求を満たしていない
7).最近,直視型EUSを用いて小さな腫瘍に対するEUS-FNAの良好な成績8(5.7%~86%)が報告されている
8),9).更に22G針を用いた2cm以上の粘膜下腫瘍に対する成績が,85.7~86%と良好な報告がなされている
10),11).GISTを診断するためには,細胞診ではなく,組織学的診断が必要でC-kit, DOG1,CD34, PDGFRA-mutation等の免疫組織学的診断を得て,その診断後外科的切除が望ましい.Miettinen,LasotaらのGISTの長期経過に関する論文によれば2cm以下のGISTでmitosisが<5/50(HPF)以下のものは,1例も転移をきたしていない,一方≧6/50(HPF)のものは,胃以外のものでは転移を認めるが胃のGISTでは1例も認めないと報告されていた
12).しかし,最近Asoらが,2cm以下の胃GISTで術後肝転移をきたした症例が報告されている
13).GISTは,他の粘膜下腫瘍と比較して発育速度(増大)が早いとされ,high risk GISTのdoubling timeが3.9カ月であり,high risk+Intermediate risk GIST群とlow risk+extremely low risk群との比較では8.2カ月vs 24.0カ月(p=0.047)と有意にhigh risk +Intermediate risk GIST群がdoublinng timeが速いとわれわれのグループは報告した
14).このようにhigh risk+Intermediate risk GIST群の増大速度が速いことを考慮すると,たとえ小さくても粘膜下腫瘍,特に4層由来の腫瘍は6カ月後に最初の経過観察を行うべきであると思われる.その時点で増大のものに対しては,EUS-FNAあるいは手術,他方変化がほとんどなければ1年の間隔に延ばせばよいと考えている.
以上の状況を鑑み,4層由来の粘膜下腫瘍に対するEUS-FNAの適応は,直視型EUSを用いるなどの工夫は必要であるが,1~2cm以上と考えている
2)平滑筋腫
平滑筋腫は,良性の粘膜下腫瘍で粘膜筋板あるいは固有筋層から由来発生する(Figure 5).粘膜筋板由来の平滑筋腫は食道がほとんどで,固有筋層由来のものはすべての消化管から発生する.先項で述べたようにEUS像のみからでは,GISTと平滑筋腫,神経鞘腫との鑑別は困難である.切除標本からのデータでは,平滑筋腫の60~80%は食道の第4層由来のものであり,胃においては噴門部に63.6~80%が,1.5~14.2%が胃体部に,1.5~2.9%が前庭部に,0~2.9%が胃底部に認められる
3),4).平滑筋腫には,6.5~18%に石灰化が認められるが,この頻度はGISTの0~3.5%,神経鞘腫の0~3.7%と比較して高頻度であり鑑別点の一つである
3),5),15).平滑筋腫を診断するためには,組織学的にdesmin(+),C-kit(-),CD34(-)を証明する必要性があり,先に述べたように1~2cm以上の4層由来の腫瘍に対してはEUS-FNAを行う必要性がある.一方それ以下の小さな腫瘍は,最初は6カ月後経過観察を行うべきである.平滑筋腫のdoubling timeは231.2月と長く,増大がなければ次回は1年後の経過観察とする
14).しかし,EUS像で結節分葉状,内部不均一,無エコー域,潰瘍などの所見がある症例は,たとえ1~2cm以下であってもEUS-FNAを施行すべきである.
3)神経鞘腫
神経鞘腫は,多くはAuerbach神経叢から,稀に Meissner神経叢のSchwann細胞から発生する紡錘形細胞からなる腫瘍で,程度は低いが悪性腫瘍とされる(Figure 6).先に述べたようにこの腫瘍も画像によるGIST,平滑筋腫との鑑別が難しい.神経鞘腫は,胃切除例の2~8.3%を占め,胃においては57~81%が胃体部に,7.4~40%が前庭部に,0~29.6%が胃底部に認められる
3),4),15),16).石灰化は,神経鞘腫には稀で,0~3.7%に認められる
3),15).神経鞘腫を診断するためには,組織学的に,S100(+), C-kit(-), CD34(-)を証明する必要性がある.そのためには前項と同様に,4層由来の1~2cm以上の粘膜下腫瘍はEUS-FNAが必要である.因みに神経鞘腫のdoubling timeは,104.7カ月とかなり遅く,経過観察においてかなりの鑑別点となる
14).
4)迷入膵
迷入膵は,本来の膵臓と解剖学的,血管系との連続性がない膵組織として定義される.多くの迷入膵は無症状で検診等により偶然発見されるが,稀に消化管出血で発症する症例も報告されている
17).EUS的には,迷入膵は3層だけに限局する浅層型(Figure 7)と,3~4層に跨って存在する深層型(Figure 8)に分類される.1909年Heinrichは,迷入膵を組織学的に3型に分類した.Ⅰ型は,腺房細胞,膵管とランゲルハンス島のすべての成分を有するもので,一般的にこの型は胃中部,胃上部に存在することが多い,Ⅱ型は,分葉構造を有し腺房細胞,膵管からなり内分泌成分は欠如する不完全型,Ⅲ型は,腺管の増殖と腺房細胞か内分泌成分のいずれかを有するもの
18).このため,Ⅰ型などでは時に管腔構造がEUSで描出される.また,管腔の出口がない場合には,嚢胞成分が描出されることも<10%の症例で見られるが,基本的にはSolidな腫瘍である
19).消化管での迷入膵の存在部位は,胃(特に前庭部)38-26%,十二指腸28-36%,そして空腸16%とされるが,切除例の統計のためか胃の頻度が低いと思われる
3),4),18).迷入膵は,その他大腸,脾臓,胆嚢,肝臓,メッケル憩室,胆管などにも見られる
11),19).通常内視鏡の観察では,迷入膵は中央陥凹を有する円形から楕円形の粘膜下腫瘍で,前庭部に多く認められる.迷入膵は,膵組織の正常組織への迷入が基本であるため,特徴的なEUS像は不明瞭な境界と思われる.前庭部に好発し,内部エコーは不均一であり,やや低エコー~低エコー,で時に管腔構造や嚢胞成分を有する.深層型は,胃中部,胃上部に見られることが多く,その多くは大型のものが多く,先にも述べたが“4層の肥厚”所見がこの型の特徴である(Figure 8).
5)脂肪腫
脂肪腫は,成熟した脂肪細胞から構成される良性の粘膜下腫瘍であり,胃前庭部や十二指腸,胃体部に多く認められる.通常内視鏡では,一般的に孤立性の柔らかな腫瘍で黄色を呈するとされるが,それは大腸,十二指腸の場合であり,胃では粘膜が厚く通常との区別が難しいものが多い.十二指腸,大腸では山田Ⅳ型のような茎を有するようなものも見られるが,胃脂肪腫の多くは丈の低いものが多く,そして脂肪腫の柔らかさの確認には鉗子で押すと凹むクッションサインを確認する.脂肪腫のEUS像は特徴的で,第3層由来で均一な高エコーを呈し,EUSだけで診断可のであり,EUS-FNAの必要はないと思われる(Figure 9).
6)神経内分泌腫瘍(NET,カルチノイド腫瘍)
現在消化管神経内分泌腫瘍GI-NENは,G1(以前はcarcinoid腫瘍と呼ばれた),G2とG3(いわゆるNEC)に分類されている
20).一方膵NENは,G3を分化型のNEN-G3と未分化型NECに分類されることとなった.NENは,40~50歳に好発し,男女比は2:1と男性に多いとされる
21).GI-NENは,欧米と異なり,日本では直腸,十二指腸,胃に多く見られる.通常内視鏡的には,小さな,円形の,粘膜下腫瘍で,拡張した血管を有し,時に頂部の陥凹や潰瘍を有する隆起形を呈する(Figure 10).

NEN腫瘍は,食道から直腸まで全消化管に存在するが,enterochromaffin-like cell(ECL細胞)に由来する腫瘍で,Rendiは胃NEN(G-NEN)を,Ⅰ型は,非転移性で,胃底部の萎縮性胃炎が特徴的で,高ガストリン血症伴うもの(70~80%),Ⅱ型は,局所転移性で,過形成性胃炎と高ガストリン血症(ゾリンジャーエリソン症候群)を伴いMEN-1の結果として見られる(5~10%),Ⅲ型は,浸潤性で,転移性であり,組織学的にも異なり,分裂指数の高い退形成性の小から中間的な細胞からなり,部分的な壊死を伴うもので,ガストリンとは無関係に発生するものの3型に分類される
22).NCCNのガイドラインによれば,Ⅰ型,Ⅱ型のG-NENは,経過観察か20mmより小さく,筋層以下に浸潤がなく,転移を有さないものは,数が複数であっても内視鏡切除が推奨されている.20mm以上の場合には,1つでも複数でも外科的切除が推奨されている.Ⅲ型G-NENの場合には,胃癌と同じ対応が推奨されているが,<2cmのものは内視鏡切除や,楔状切除が考慮される.十二指腸NEN(D-NEN)に関しては,ENETS(European Neuroendocrine Tumor Society)のガイドラインでは,1cm以下の乳頭部以外のD-NENで,転移がなくかつ非機能性のものは内視鏡的切除が推奨されている.乳頭部のD-NENは,局所切除とリンパ節廓清が推奨されている.D-NENで1-2cmのものは内視鏡切除か外科的切除かはコンセンサスが得られていない.>2cmのD-NENは,外科的切除とリンパ節廓清が推奨されている.NCCNでは,切除可能なら内視鏡切除を優先的に考慮するとしている.日本では,D-NENは1cm以下では内視鏡切除が考慮され,>1cmでは外科的切除が推奨されている.
7)ガストリノーマ
ガストリノーマは,NENの1種で,低エコーの腫瘤で,十二指腸の第3層から発生するものが多い.しかし,この腫瘍は小さいにも関わらず,深部へ浸潤したり,リンパ節転移をきたし易い傾向がある.通常内視鏡では,十二指腸に存在するガストリノーマは一般に頂部に陥凹を有する小さな腫瘍が多い.このため,臨床上でEUS-FNAでの診断は困難であり,通常内視鏡による鉗子生検により診断されることが多い(Figure 11).
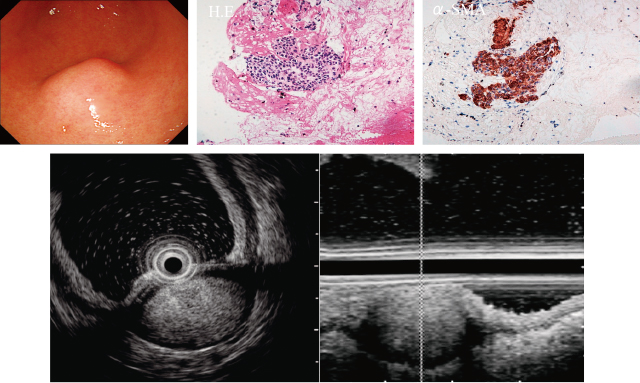
8)Glomus腫瘍
Glomus腫瘍は,平滑筋のGlomus 小体から発生する間葉系腫瘍で,一般的には四肢末端や体幹の皮下に疼痛を伴う腫瘍として知られているが,胃に発生する腫瘍は稀であり,現在までに90余例の報告がある.好発年齢は,45歳(median)で,男女比は1:1.6と女性にやや多いとされる.また,Fangらによれば,61%の症例が上腹部痛あるいは腹満感,25%が消化管出血,14%が無症状であったと報告している
23).一般的に好発部位は,前庭部で約85%症例が同部に存在する.その組織像をMassonは,①angiomatous form,②epitheloid form,③neurofibro-matous formm,④degenerative formの4型に分類している
24).また,由来層は,固有筋層,粘膜下層であり,血流が豊富な腫瘤である場合が多い.それゆえ典型的なEUS像は,固有筋層,粘膜下層由来の等エコー(固有筋層よりエコーレベルが高い)で内部は均一な場合が多いが,先に述べたMasson分類により,低エコー,不均一な腫瘤である場合もある(Figure 12).組織学的な診断は,免疫組織学的にα-smooth muscle actin(SMA)(+), vimentin(+), laminin(+), CD34(稀), c-kit(-)である.コントラストエコー,造影CTでは,hypervascular patternを呈することが多い.
9)リンパ管腫
リンパ管腫は,稀な良性腫瘍である.最も好発するのは小児で,頸部,腋窩に多く発症する.一方成人では,稀な腫瘤で特に腹部臓器に見られるのは極めて稀である.通常内視鏡では,柔らかで,孤立性の丈が低い粘膜下腫瘍であり,クッションサイン陽性を示す.EUS像では,第3層由来の無エコーの嚢胞性腫瘤で隔壁を有するのが特徴的で,多くはEUS-FNAを必要とせず診断可能である(Figure 13).リンパ管腫は,過誤腫,稀に嚢胞成分を有する迷入膵と異なり,Solid成分を認めない.更に,リンパ管腫は,時に胃外まで拡がっている場合もある.
10)過誤腫
過誤腫は,第3層由来で,実質成分と嚢胞成分からなる腫瘤である(Figure 14).そのため,時に嚢胞成分の大きな迷入膵との鑑別が困難となる.過誤腫は,組織学的には胃腺が第3層へ迷入したものであるため,EUS-FNAを行ったとしても,正常胃組織が採取され,contaminationと判断される可能性があり,正確な診断は難しいのである.
11)顆粒細胞腫
顆粒細胞腫は,食道で好発し,稀に胃,大腸でも見られる.多くのものは良性とされるが,悪性例の報告もあり,特に胃,大腸で悪性例の報告が見られる.通常内視鏡的には,一般的に小さく(20mm以下),黄色を呈し,括れを有する粘膜腫瘍で,臼歯状を呈するのが特徴的とされる.EUSでは,低エコーで,均一で境界明瞭な腫瘤で,多くは第2層から発生している(Figure 15).しかし,胃,大腸では第2,3層由来とされ,悪性例の報告があるため,注意が必要である.食道では,低エコーで均一な2層由来であるため,粘膜筋板由来の平滑筋腫との鑑別が問題となるが,平滑筋腫は円形で隆起が目立ち,顆粒細胞腫は臼歯状である点が特徴的であり,また内視鏡生検で診断可能である.
12)ブルンナー腺腫
ブルンナー腺腫は,十二指腸では最も頻度が高く,第3層由来の粘膜下腫瘍である(Figure 16).内部エコーレベルは,低エコーであり,時に嚢胞成分が認められる.ブルンナー腺腫の多くは,無症状で他疾患のためあるいは検診の内視鏡などで発見されることが良いが,大きくなると出血等を主訴とする場合もある.十二指腸では,第3層由来の脂肪腫も好発するが,エコーレベルで鑑別が可能である.
Ⅳ EUS-FNA
1)粘膜下腫瘍に対する適応
消化管粘膜下腫瘍に対するEUS-FNAの第一の適応は,第4層由来のGIST,平滑筋腫,神経鞘腫の鑑別である.そしてこれに続いて,稀な粘膜下腫瘍,神経内分泌腫瘍(NEN,carcinoid腫瘍),Glomus腫瘍,顆粒細胞腫などの通常とは異なる様相を呈する腫瘤が対象となる.一方,迷入膵が疑われる腫瘤に対するEUS-FNAは,手術をしないための組織学的診断目的となる.先にも述べたが,第4層由来の腫瘤では,結節分葉状,内部不均一,無エコー域,潰瘍などの所見を認めたら行うべきである.要するに,通常とは異なった様相を呈した粘膜下腫瘍は適応となるのである.
先にも述べたが,小さな粘膜下腫瘍に対するEUS-FNAの診断率は臨床的要求を満たしていない
8).一方2cm以上の粘膜下腫瘍に対する22G針を用いたEUS-FNAの診断率は85.7~86%と報告されている
10),11).しかし,最近では2cm未満の症例でも術後転移例が報告されているため,1~2cm以上を対象とすべきである.しかし,High risk, Intermediate riskのGISTを見逃さないために経過観察する場合には,最初は6カ月後に内視鏡,EUSを行うべきである
14).なぜなら,High risk GIST群,High risk+Intermediate risk GIST群はDoubling timeが,それぞれ3.9カ月,8.2カ月と短いことが報告されているのである.この時点で増大が明らかならば積極的にEUS-FNAか手術による切除を勧めるべきである.増大がほとんどない場合には,1年後の経過観察とする.しかしながら1~2cm未満であっても,通常とは異なる様相の粘膜下腫瘍に対しては積極的にEUS-FNAを行うべきである.
2)新しいEUS-FNA
一般的に粘膜下腫瘍に対するEUS-FNAは,難しいと言われている.なぜならば,可動性がその主因だからである.すなわち,周囲臓器に囲まれて可動性の乏しい膵腫瘍では,5~10mmであってもその穿刺は可能である.しかし,小さな(一般に2cm以下)粘膜下腫瘍に対するEUS-FNAの診断成績が不良であるのは穿刺の困難性によると思われる.これに対して,近年フードを装着した直視型EUSを用いることでその成績が向上できることが明らかとなってきた(Figure 17)
8),9),25).すなわち,フードを接着させ,吸引を行い粘膜下腫瘍を固定することで穿刺が容易となるわけである.この方法により,2cm以下の粘膜下腫瘍に対しても臨床的な要求にある程度答えられる成績が得られるようになった.
Ⅴ まとめ
上部消化管粘膜下腫瘍に対するEUS,EUS-FNAについて述べてきたが,本稿がこれから始める初心者,研修中の諸氏の一助となることを期待したい.
文 献
- 1. Aibe T. A Study on the structure of layers of the gastrointestinal wall visualized by means of the ultrasonic endoscope. 1) the structure of layers of the gastric wall. (in Japanese with English abstracts)Gastroenterol Endosc 1984; 26: 1447-64.
- 2. Vilmann P, Jacobsen GK, Henriksen FW et al. Endoscopic ultrasonography with guided fine needle aspiration biopsy in pancreas disease. Gastrointest Endosc 1992; 38: 172-3.
- 3. Min YW, Park HN, Min BH et al. Preoperative predictive factors for gastrointestinal stromal tumors: Analysis of 375 surgically resected gastric subepithelial tumors. J Gastroenterol Surg 2015; 19: 631-8.
- 4. Seo SW, Hong SJ, Han JP et al. Accuracy of a scoring system for the differential diagnosis of common gastric subepithelial tumors based on endoscopic ultrasonography. J Digest Dis 2013; 14: 647-53.
- 5. Yamada Y, Kida M, Sakaguchi T et al. A study on myogenic tumor of the upper gastrointestinal tract by endoscopic ultrasonography. Dig Endosc 1992; 4: 396-404.
- 6. Sakamoto H, Kitano M, Matsui S et al. Estimation of malignant potential of GI stromal tumors by contrast-enhanced harmonic echo. Gastrointest Endosc 2011; 73: 227-37.
- 7. Hoda KM, Rodriguez SA, Faigel DO. EUS-guided sampling of suspected GI stromal tumors. Gastrointest Endosc 2009; 69: 1218-23.
- 8. Larghi A, Fuccio L, Chiarello G et al. Fine-needle tissue acquisition from subepithelial lesions using a forward-viewing linear echoendoscope. Endoscopy 2014; 46: 39-45.
- 9. Yamabe A, Irisawa A, Bhutani MS et al. Usefulness of endoscopic ultrasound guided fine-needle aspiration with a forward-viewing and curved linear-array echoendoscope for small gastrointestinal subepithelial lesions. Endosc Int Open 2015; 3: E161-4.
- 10. Lee JH, Cho CJ, Park YS et al. EUS-guided 22-guage fine needle biopsy for the diagnosis of gastric subepithelial tumors larger than 2cm. Scand J Gastroenterol 2016; 51: 485-92.
- 11. Lee M, Min BH, Lee H et al. Feasibility and diagnostic yield of endoscopic ultrasonography-guided fine needle biopsy with a new core biopsy needle device in patients with gastric subepithelial tumors. Medicine 2015; 94: 1-7.
- 12. Miettinen M, Lasota J. Gastrointestinal stromal tumors: pathology and prognosis at different sites. Semin Diagn Pathol 2006; 23: 70-83.
- 13. Aso A, Ihara E, Kubo H et al. Gastric gastrointestinal stromal tumor smaller than 20 mm with liver metastasis. Clin J Gastroenterol 2013; 6: 29-32.
- 14. Koizumi S, Kida M, Yamauchi H et al. Doubling time of gastrointestinal tumors. World J Gastroenterol in press.
- 15. Yoon JM, Kim GH, Park DY et al. Endosonographic features of gastric schwannoma: A single center experience. Clin Endosc 2016 15. ahead of print.
- 16. Tao K, Chang W, Zhao E et al. Clinicopathologic features of gastric schwannoma. Medicine 2015; 94: 1-6.
- 17. Lee MJ, Chang JH, Maeng H et al. Ectopic pancreas bleeding in the jejunum revealed by capsule endoscopy. Clin Endosc 2012; 45: 194-7.
- 18. Heinrich H. Ein Beitag zur Historogie des sogen akzessorischen pancreas. Virchow Arch 1909; 198: 39819-401.
- 19. O’Malley RB, Maturen KE, Al-Hawary MM et al. Case of the season: ectopic pancreas Seminars in roentgenology. Seminar Roentgenol 2013; 48: 188-91.
- 20. Rindi G, Arnold R, Bosman FT et al. Nomenclature and classification of neuroendocrine neoplasms the digestive system. In: Bosman FT, Carneiro F, Hrubasn RH, Theise ND, editors. WHO classification of tumors of the digestive system. IARC, Lyon, 2010; 13-4.
- 21. Soga J.Gastric carcinoids: A statistic evaluation of 1094 cases collected from the literature. Surg Today 1997; 27: 893-901.
- 22. Rindi G, Luinetti O, Cornaggia M et al. Three subtype of gastric argyrophil carcinoids and the gastric neuroendocrine carcinoma: A clinicopathologic study. Gastroenterology 1993; 104: 994-1006.
- 23. Fang HQ, Yang J, Zhang FF et al. Clinicopathological features of gastric glomus tumor. World J Gastroenterol 2010; 16: 4616-20.
- 24. Wang ZB, Yuan J, Shi HY. Features of gastric glomus tumor: a clinicopathologic immunohistochemical and molecular retrospective study. Int J Clin Exp Pathol 2014; 7: 1438-48.
- 25. Matsuzaki I, Miyahara R, Hirooka Y et al. Forward-viewing versus oblique-viewing echoendoscopes in the diagnosis of upper GI subepithelial lesions with EUS-guided FNA:a prospective, randomized, crossover study. Gastrointest Endosc 2015; 82: 287-95.
 https://orcid.org/0000-0003-2420-1176
https://orcid.org/0000-0003-2420-1176